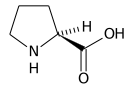
Negli esseri umani è un amminoacido non essenziale, cioè, l'organismo umano è in grado di sintetizzarlo. Va anche incontro a degradazione ad opera di un'ossidasi, che tramite l'intermedio glutammato-gamma-semialdeide la converte in acido glutammico.
Nelle proteine, data la sua struttura unica, impedisce alla catena polipeptidica di formare delle eliche α e funge da punto di svolta nei foglietti β. Formando un legame peptidico con un altro amminoacido, la prolina forma un'ammide terziaria, non ha quindi atomi di idrogeno per formare legami a idrogeno con le restanti parti del polipeptide.
Più proline in sequenza si conformano a loro volta in una tipica struttura ad elica. Esistono proteine che incorporano nella loro sequenza un'elevata percentuale di residui di prolina. Una di queste è il collagene, proteina strutturale ubiquitaria nei tessuti animali ed umani. Grazie alla sua conformazione ad elica, il collagene acquisisce proprietà fisiche e meccaniche particolari. In dettaglio, assume una elasticità molto limitata alle trazioni di basse intensità; continuando la sua trazione, si arriva ad una soglia in cui minime variazioni trattive provocano estensioni non proporzionali della sua struttura. Il collagene strutturato maturo è anche una proteina con proprietà ottiche: possiede infatti birifrangenza.
La trasduzione del segnale intracellulare si serve spesso di proteine che possiedono domini dove le concentrazioni di prolina sono discrete (poly-proline stretches), ma più abbondanti rispetto alla sequenza proteica integrale. Questi domini ricchi di prolina, ad alfa elica, fungono da ligandi per delle "tasche" molecolari che furono identificate inizialmente in alcune protein tirosina chinasi citoplasmatiche, come il proto-oncogene c-Src o la tirosina chinasi linfocitaria Ltk. Si chiamano domini SH3 (Src Homology number 3)e una volta legati queste sequenze di poli-prolina, inducono una modificazione conformazionale delle proteine in cui sono contenuti. Come risultato, es. la tirosina chinasi può attivarsi o rallentare la sua funzione. Anche lachinasi attivata dai fosfoinositidi (PI-3K) possiede due domini SH3 in grado di legare diversi tipi di sequenze di poli-prolina.
Aiuta alla riformazione di tessuto muscolare. Partecipa all'adeguato funzionamento del muscolo cardiaco. Apporta immediata disponibilità di energia per il fegato e per i muscoli. Gli alimenti ricchi di questo aminoacido sono: biscotti per l'infanzia, frumento, fette biscottate, pane, pasta, semola, lenticchie, asparagi, funghi, spinaci, arachidi, nocciole, coniglio, e formaggi.
![]()